
اسیدها ترکیباتی هستند که در بسیاری از واکنشهای شیمیایی و فرآیندهای صنعتی نقش حیاتی دارند. اما قویترین اسیدها از نظر قدرت اسیدی در حدی هستند که حتی میتوانند موادی را حل کنند که اسیدهای معمولی قادر به انجام آن نیستند. در این پست، با قویترین و البته خطرناکترین اسید شناخته شده آشنا میشویم.
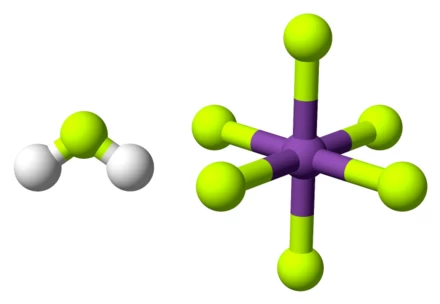
برخی اسیدها آنقدر بیخطر هستند که حتی افراد عادی در خانه میتوانند از آنها استفاده کنند، مثل اسید موریاتیک. این اسید برای استفاده به عنوان یک پاککننده خانگی طراحی شده است، البته به شرطی که دستورالعملها و تمام نکات ایمنی رعایت شوند. اما برخی دیگر از اسیدها آنقدر خورنده و سوزاننده هستند که هیچکس نباید آنها را دستکاری کند. حالا چه اتفاقی میافتد اگر دو اسید از این نوع را با هم ترکیب کنیم؟ چیزی بسیار قویتر از هرکدام بهتنهایی به دست میآید. برای مثال، وقتی مقدار مساوی از اسیدهای هیدروژن فلوراید (HF) و آنتیموان پنتافلوراید (SbF5) با هم ترکیب میشوند، نتیجه آنقدر خارقالعاده است که نمیتوان آن را نادیده گرفت. آنچه به دست میآید فقط یک اسید دیگر نیست؛ بلکه قویترین اسید شناختهشده برای بشر است، که به آن سوپراسید گفته میشود: اسید فلوئوروآنتیمونیک، با فرمول HSbF6.
اسید فلوئوروآنتیمونیک چیست؟ اسید فلوئوروآنتیمونیک یک مایع بیرنگ است که بخار سمی از خود منتشر میکند. بلعیدن یا استنشاق آن میتواند کشنده باشد، و تماس با پوست؟ یعنی سوختگیهای شدید. این اسید در دسته سوپراسیدها قرار دارد، گروهی از اسیدهای قوی که قدرت اسیدی آنها از اسید سولفوریک نیز فراتر میرود. با توجه به قدرت بسیار بالای آن، نمیتوان از مقیاسهای معمول pH یا pKA برای اندازهگیری قدرت این اسید استفاده کرد. در اینجا، تابع اسیدیته همت (Hammett acidity function) که با H نمایش داده میشود، اهمیت پیدا میکند. اسید فلوئورآنتیمونیک مقدار H برابر با -21 دارد، در حالی که اسید سولفوریک H برابر با -12 ثبت کرده است. به زبان سادهتر، اسید فلوئورآنتیمونیک حدوداً ۲۰ × ۱۰¹⁹ برابر قویتر از اسید سولفوریک خالص است. هیدروژن فلوراید و یونهای هیدروژن این بخش اصلی و پایهای قهرمان ما، یعنی اسید فلوئوروآنتیمونیک است. یونهای هیدروژن (H⁺) باعث اسیدی شدن یک ماده میشوند و هر چه غلظت آنها بیشتر باشد، اسید قویتر است. هیدروژن فلوراید به تنهایی قویترین اسید نیست، اما یکی از اجزای کلیدی برخی از اسیدهای بسیار قوی است.
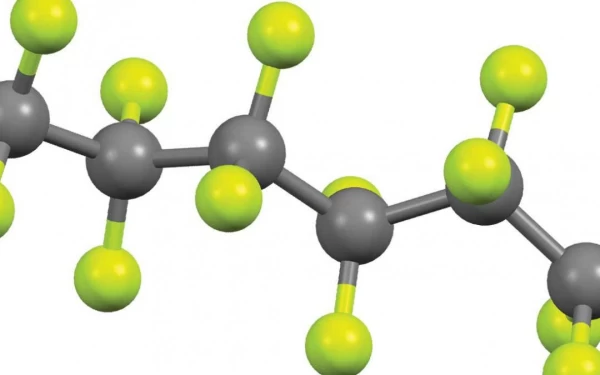
نقطه ضعف فلوئوروآنتیمونیک اسید: تفلون با وجود قدرت بسیار زیادش، فلوئوروآنتیمونیک اسید یک نقطه ضعف دارد: نمیتواند پلی تترافلوئورو اتیلن (PTFE) که به طور معمول با نام تفلون شناخته میشود را خورده و از بین ببرد. به همین دلیل، ظروف تفلونی به عنوان مخازن انتخابی برای نگهداری این مایع قدرتمند استفاده میشوند. روش دیگر نگهداری، قرار دادن آن در محلول اسید هیدروفلوریک است که در آن فلوئوروآنتیمونیک اسید دچار تجزیه انفجاری نمیشود. اما مراقب باشید — این اسید میتواند شیشه، بیشتر پلاستیکها و تمامی ترکیبات آلی را حل کند. حتی با آب نیز واکنش انفجاری نشان میدهد.

پروتونه کردن: ابرقدرت فلوئوروآنتیمونیک اسید توانایی ویژه فلوئوروآنتیمونیک اسید، پروتونه کردن است — یعنی این اسید پروتونها (یونهای هیدروژن) را به ترکیبات آلی اهدا میکند. این کار باعث تغییر ویژگیهایی مانند جرم، حلالیت و هیدروفیل در آن ترکیبات میشود. چنین ویژگیای برای شیمیدانها بسیار ارزشمند است و در واکنشهای شیمیایی، حکاکی روی شیشه، پالایش بنزین و حتی ساخت مواد منفجره کاربرد دارد. اگرچه این اسید عنوان قویترین اسید جهان را دارد، اما برخی معتقدند اسید هیدروفلوریک خطرناکتر است؛ چون در محصولات رایجتری یافت میشود و احتمال مواجههی تصادفی با آن بیشتر است. برای کسانی که شجاعت کار با سوپراسیدها را دارند، استفاده از تجهیزات حفاظت شخصی مانند ماسک تنفسی و عینک محافظ الزامی است. اینها همان زره مدرن شیمیدانها در برابر مادهای هستند که میتواند در چشم بر هم زدنی گوشت و استخوان را حل کند.
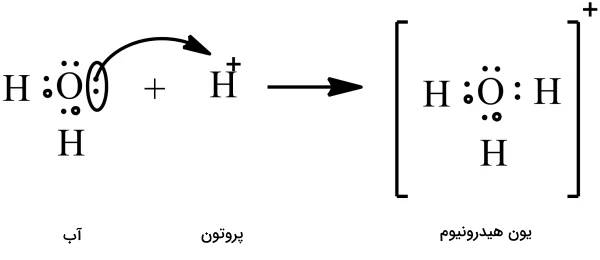
مقایسه با اسیدهای دیگر دنیای شیمی گسترده است، و در حالی که اسید فلوئوروآنتیمونیک جایگاه ویژهای دارد، اسیدهای جذاب دیگری نیز وجود دارند که شایستهی توجهاند. بیایید به ویژگیهای منحصر بهفرد این اسیدها بپردازیم و قدرت، ضعف و نقش آنها در فرآیندهای مختلف را بررسی کنیم. اسیدهای کربوران این اسیدها از جمله قویترین اسیدها هستند و تنها پس از اسید فلوئوروآنتیمونیک قرار دارند. ساختار مولکولی خاص آنها به آنها کمک میکند تا قدرت خود را حفظ کنند. آنچه آنها را متمایز میکند پیوند ضعیفشان با یونهای هیدروژن است، که آنها را نسبت به اسید فلوئوروآنتیمونیک کمتر خورنده میکند. اسید جادویی (Magic Acid) نامش افسانهای به نظر میرسد، اما اسید جادویی کاملاً واقعی است! این اسید از ترکیب اسید فلوئوروسولفوریک (HSO₃F) و پنتافلوراید آنتیموان (SbF₅) بهوجود میآید. این اسید در محلول آبی کاملاً تفکیک میشود و غلظت بالایی از یونهای هیدروژن آزاد میکند. اسید نیتریک، اسید فسفریک و اسید پرکلریک اینها نمونههایی از اسیدهای قوی هستند که هنگام حل شدن در آب، بهطور کامل تفکیک میشوند. با اینکه ممکن است به اندازهی اسید فلوئوروآنتیمونیک اسیدی نباشند، اما در صنایع مختلف — از تولید کود شیمیایی تا سوخت موشک — نقش اساسی دارند. اسید بنزوئیک و اسید اگزالیک این اسیدهای ضعیف بهطور کامل در آب تفکیک نمیشوند. با این حال، در زندگی روزمره نقش مهمی دارند — از نگهداری مواد غذایی گرفته تا استفاده در مواد پاککننده. یون هیدرونیوم تمام اسیدها هنگام حل شدن در آب، این یون با بار مثبت را تولید میکنند. این یون عامل اصلی خاصیت اسیدی یک محلول است.
اگر پسندیدی، لایک کن و به سازنده انرژی بده!



عالی بود
به امید ویژه شدن🍓
ممنونم
#نه_به_ناظر_بتمن
😭😂
بریم بخوریم
حمایت.
ممنون
#نه_به_ناظر_بتمن
😭😭😭😂