
عنصر پلوتونیوم عنصری که میتواند به دنیا پایان دهد

پلوتونیوم (به انگلیسی: Plutonium)، یک عنصر شیمیایی رادیواکتیو و فلزی است که نماد آن Pu و عدد اتمی آن ۹۴ میباشد. جرم اتمی این عنصر ۲۴۴٫۰۶ بوده و چگالی آن ۱۹.۸۰۰ کیلوگرم/متر مکعب میباشد. این فلز خاکستری-نقره ای رنگ از دسته عناصر آکتینیدها میباشد که در مجاورت با هوا اکسیده و سطح آن کدر میشود. این عنصر به صورت طبیعی دارای ۶ دگرشکلی یا آلتروپی و ۴ عدد اکسایش میباشد و با عناصر کربن، هالوژنها، نیتروژن، سیلیکون و هیدروژن واکنش نشان میدهد. پلوتونیوم در هنگام قرار گرفتن در هوای مرطوب، اکسیده و هیدراته میشود و حجم آن تا ۷۰٪ افزایش خواهد یافت که باعث میشود سطح خارجی آن پوسته پوسته شود و تبدیل به پودری آتش زا شود. پلوتونیوم عنصری رادیواکتیو است و در مواجه شدن اشعه آن با بدن میتواند در استخوانها جمع شوند که همین امر باعث خطرناک بودن استفاده از آن میشود.

Element 92: اورانیم (U), Actinoid Element 93: نپتونیم (Np), Actinoid Element 94: پلوتونیم (Pu), Actinoid Element 95: امریسیم (Am), Actinoid Element 96: کوریم (Cm), Actinoid Element 97: برکلیم (Bk), Actinoid Element 98: کالیفرنیم (Cf), Actinoid Element 99: اینشتینیم (Es), Actinoid Element 100: فرمیم (Fm), Actinoid Element 101: مندلیفیم (Md), Actinoid Element 102: نوبلیم (No), Actinoid Element 103: لارنسیم (Lr), Actinoid Element 104: رادرفوردیم (Rf), Transition metal Element 105: دوبنیم (Db), Transition metal Element 106: سیبورگیم (Sg), Transition metal Element 107: بوهریم (Bh), Transition metal Element 108: هاسیم (Hs), Transition metal Element 109: مایتنریم (Mt) Element 110: دارمشتادیم (Ds) Element 111: رونتگنیم (Rg) Element 112: کوپرنیسیم (Cn), Other metal Element 113: نیهونیم (Nh) Element 114: فلروویم (Fl) Element 115: مسکوویم (Mc) Element 116: لیورموریم (Lv) Element 117: تنسین (Ts) Element 118: اوگانسون (Og) Sm ↑ Pu ↓ (Uqo) نپتونیم ← پلوتونیم → آمریسیم عدد اتمی (Z) ۹۴ گروه گروه n/a دوره دوره ۷ بلوک بلوک-f دسته Actinide آرایش الکترونی [Rn] 5f6 7s2 لایه الکترونی ۲, ۸, ۱۸, ۳۲, ۲۴, ۸, ۲ ویژگیهای فیزیکی فاز در STP جامد نقطه ذوب ۹۱۲٫۵ K (۶۳۹٫۴ °C, ۱۱۸۲٫۹ °F) نقطه جوش ۳۵۰۵ K (۳۲۲۸ °C, ۵۸۴۲ °F) چگالی (near r.t.) ۱۹٫۸۱۶ g/cm3 در حالت مایع (at m.p.) ۱۶٫۶۳ g/cm3 حرارت همجوشی ۲٫۸۲ kJ/mol آنتالپی تبخیر ۳۳۳٫۵ kJ/mol ظرفیت حرارتی مولی ۳۵٫۵ J/(mol·K) فشار بخار فشار (Pa) ۱ ۱۰ ۱۰۰ ۱ K ۱۰ K ۱۰۰ K در دمای (K) ۲۵۱۱ ۲۹۲۶ ۳۴۹۹ ویژگیهای اتمی عدد اکسایش +2, +3, +4, +5, +6, +7 (an amphoteric اکسید) الکترونگاتیوی مقیاس پائولینگ: ۱٫۲۸ شعاع اتمی empirical: ۱۵۹ pm شعاع کووالانسی pm ۱۸۷±۱ Color lines in a spectral rangeخط طیف نوری پلوتونیم دیگر ویژگی ها ساختار بلوری دستگاه بلوری تکشیبMonoclinic crystal structure for پلوتونیم سرعت صوت ۲۲۶۰ m/s انبساط حرارتی ۴۶٫۷ µm/(m·K) (at 25 °C) رسانندگی گرمایی 6.74 W/(m·K) رسانش الکتریکی ۱٫۴۶۰ µΩ·m (at 0 °C) رسانش مغناطیسی paramagnetic مدول یانگ ۹۶ GPa مدول برشی ۴۳ GPa نسبت پواسون ۰٫۲۱ شماره ثبت سیایاس ۷۴۴۰-۰۷-۵ ایزوتوپ فراوانی نیمهعمر (t۱/۲)
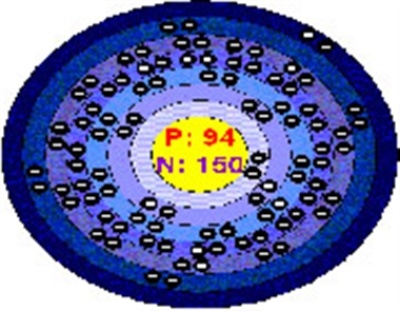
پلوتونیوم در تاریخ ۱۴ دسامبر ۱۹۴۰ توسط گلن سیبورگ، ادوین مکمیلان، ژوزف دبلیو. کندی و آرتور وال از طریق بمباران دوترونی اورانیوم-۲۳۸ در سیکلوترون (شتابدهنده ذرات مدور با قطر ۱/۵ متر (۶۰ اینچ) آزمایشگاه تشعشع دانشگاه کالیفرنیا، برکلی کشف شد. در این آزمایش ابتدا عنصر نپتونیوم-۲۳۸ با طول عمر (۲/۱ روز) ایجاد میشود و سپس از طریق واپاشی بتا تبدیل به عنصر جدید با عدد اتمی ۹۴ و وزن اتمی ۲۳۸ (با نیمه عمر ۸۸ سال) میشود. از آنجا که اورانیوم بعد از کشف سیاره اورانوس و نپتونیوم بعد از کشف سیاره نپتون نامگذاری شدند، پلوتونیوم هم بعد از کشف پلوتون (که در آن زمان در دستهبندی سیارات قرار داشت) نامگذاری شد. (پلوتون در منظومه شمسی بعد از نپتون قرار دارد). به علت ملاحظات زمان جنگ جهانی دوم، دانشگاه کالیفرنیا، برکلی تا سال ۱۹۴۸ از منتشر کردن این اکتشاف، خودداری کرد. پلوتونیوم دارای بیشترین عدد اتمی است که به صورت طبیعی یافت میشود. مقادیر ناچیزی از آن در بقایای اورانیوم-۲۳۸ که نوترون حاصل از واپاشی دیگر اتمهای اورانیوم-۲۳۸ اطراف را جذب کردهاست دیده میشود. از سال ۱۹۴۵، پلوتونیوم به عنوان محصولی از فرایند گیراندازی نوترون و واپاشی بتا (فرایندی که نوترونها در جریان شکافت هسته ای، اورانیوم-۲۳۸ را تبدیل به پلوتونیوم-۲۳۹ میکند)، بسیار رایج تر شدهاست. تعداد ایزوتوپهای پلوتونیوم در زنجیرههای واپاشی و در یک زمان مشخص، با استفاده از معادله بیتمن محاسبه میشود. دو ایزوتوپ پلوتونیوم-۲۳۹ و پلوتونیوم-۲۴۱ شکاف پذیر هستند به این معنی که میتوانند واکنش زنجیره ای هسته ای واپاشی را ادامه دهند که موجب استفاده آن ها در تسلیحات هسته ای و رآکتورهای هستهای میشود.
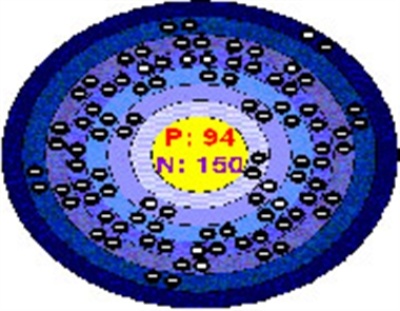
ایزوتوپ پلوتونیوم، پلوتونیوم ۲۳۹ بوده که نیمه عمر آن ۲۴۲۰۰ سال میباشد و به دلیل نیمه عمر کوتاه آن، رد بسیار ناچیزی از پلوتونیم به صورت طبیعی در معادن یافت میشود. پلوتونیوم ۲۳۹، در رآکتورهای هستهای از اورانیوم ۲۳۸ و در مقیاسهای بالا تولید میشود. ایزوتوپ پلوتونیوم-۲۳۸ ساطعکننده اشعه آلفا میباشد که نیمه عمرش ۸۷ سال است. این خصوصیات آن را برای استفاده در تولید نیروی برق برای دستگاههایی که میبایست بدون نگهداری مستقیم در مقیاسهای زمانی حدوداً برابر عمر انسان کار کنند، مناسب میکند؛ بنابراین در مولد های گرما-الکتریکی ایزوتوپی مانند آنهایی که نیروی کاوشگرهای فضایی گالیله و کاسینی-هویگنس را تأمین میکنند، کاربرد دارد. همچنین پلوتونیوم چهار ظرفیت یونی را در محلولهای آبی از خود نشاد میدهد: Pu+3 (آبی کمرنگ) Pu+4 ،PuO+ و PuO+2 ین PuO+ در محلولهای آبی پایدار نیست و تناسبی با Pu+4 و PuO+2 ندارد. Pu+4 میتواند PuO+ را به PuO+2 تبدیل کرده و خودش به PuO+3 تبدیل شود و یک PuO+ و PuO+3 آزاد کند. پلوتونیوم ترکیبات دوتایی PuO و PuO2 را با اکسیژن شکل میدهد و با هیدراتهای PuF3 ,PuF4 ,PuCl3 ,PuBr3 ،PuI3، کربن، نیتروژن و سیلیسیم در ترکیبات متغیر مداخله میکند. Puc ،PuN ،PuSi2 و اکسی هالیدها نیز شناخته شده میباشند: PuOCL ،PuObr ،PuOI
کاربرد پلوتونیوم: پلوتونیوم یکی از مواد مهم شکافت هستهای در سلاحهای هستهای پیشرفتهاست. باید احتیاط لازم جهت جلوگیری از جمع شدن مقداری از پلوتونیوم که به جرم بحرانی نزدیک میشود به عمل آورد، چرا که این مقدار از پلوتونیوم خودبه خود واکنشهای شکافت هستهای تولید میکند. بدون توجه به محدود نشدن پلوتونیوم توسط فشار خارجی که برای یک سلاح هستهای لازم است، پلوتونیوم میتواند خودش را گرم کرده و هر چیزی را که پیرامون آن را محدود میکند بشکند، جلوگیری شود. شکل ظاهری پلوتونیوم هم در این امر مؤثر است؛ بنابراین، باید از ایجاد اشکال فشرده مانند کره پرهیز کرد. همچنین پلوتونیوم مخصوصاً نوع بسیار خالص آن، آتش زا بوده و به صورت شیمیایی با اکسیژن و آب واکنش میدهد که میتواند باعث انباشتگی هیدرید پلوتونیوم و یک ترکیب پیروفوریسیته شود، که مادهای است که در دمای اتاق در هوا میسوزد. حجم پلوتونیوم به هنگام ترکیب شدن با اکسیژن بسیار افزایش مییابد و میتواند ظرف خود را بشکند بنابراین احتیاطهای لازم برای حمل پلوتونیوم در هر شکل آن باید انجام شود، عموماً یک اتمسفر خشک و خنثی نیاز میباشد.[۱] علاوه بر اینها، خطرات رادیو اکتیوی نیز وجود دارد. خاک اکسید منیزیم مؤثرترین ماده برای فرونشاندن آتش پلوتونیوم میباشد. آن ماده مشتعل را مانند یک کاهنده دما (Heat Sink) سرد میکند و در عین حال از رسیدن اکسیژن به آن جلوگیری میکند. آب نیز در این مورد مؤثر است. در سال ۱۹۶۲ در کارخانه راکی فلتس در نزدیکی بولدر، کلرادو، یک آتشسوزی بزرگ پلوتونیومی رخ داد. پلوتونیوم همچنین در ساخت جنگافزار هستهای و ساخت زهر (نه الزاماً مهلک) کاربرد دارد. تودههای انباشته شده پلوتونیوم توسط اتحاد جماهیر شوروی و ایالات متحده آمریکا به وجود میآمد. از پایان جنگ سرد تمرکز بر نگرانی از گسترش تکنولوژی هستهای به وجود آمد. در سال ۲۰۰۲، وزارت انرژی ایالات متحده آمریکا، ۳۴ تن از مواد پلوتونیوم را که برای ساخت سلاحهای هستهای استفاده میشد را از وزارت دفاع ایالات متحده آمریکا گرفت و از اوایل سال ۲۰۰۳ تصمیم گرفت که برای خلاصی از این اورانیومها، به تبدیل چندین نیروگاه هستهای در آمریکا، از سوخت اورانیوم غنی شده به سوخت اکسید شده ترکیبی اقدام کند.
خطرات پلوتونیوم: گاهی از پلوتونیوم با عنوان سمیترین ماده شناخته شده بر انسان نام برده میشود و این در حالی است که یک توافق کلی در میان کارشناسان مبنی بر نادرست بودن این مطلب وجود دارد. تا سال ۲۰۰۳، تنها یک مورد مرگ انسان به علت مجاورت و ارتباط با پلوتونیوم وجود داشتهاست. رادیومی که به صورت طبیعی به وجود میآید حدوداً ۲۰۰ برابر سمی تر از پلوتونیوم است و برخی از توکسین های آلی مانند سم بوتولین میلیاردها برابر سمی تر از پلوتونیوم میباشند. به هر حال، حوادث بحرانی نیز وجود داشته است . حمل بیملاحظه ۶٫۲ کیلوگرم پلوتونیوم کروی در لس آلاموس، نیومکزیکو در ۲۱ اوت ۱۹۴۵، باعث انتشار دوز مرگبار تشعشع گردید. هری کی. داغلیان دوزی در حدود ۵۱۰ معادل انسانی رونتگن دریافت کرد، او ۴ هفته بعد درگذشت. مرگ دیگری در سال ۱۹۵۸ در واحد غنیسازی اورانیوم لس آلاموس، نیومکزیکو روی داد. پلوتونیوم در یک مخزن مخلوط کن جمع شده بود. یک بار جدید هم به آن منتقل شد و در نتیجه ۸ کیلوگرم پلوتونیوم در مرکز مخزن جمع شد. یک کارگر در معرض تشعشع قرار گرفت و در کمتر از دو روز در گذشت. حالتهای سمی پلوتونیوم از نظر شیمیایی و پرتوشناسی، باید از خطرات پلوتونیوم متمایز شود. بسیاری از جنبشهای ضد هستهای و در ادامه جنبشهای سیاست سبز از پلوتونیوم به عنوان خطرناکترین ماده شناخته شده برای بشریت یاد کرده و تنها دلیلشان نقش مهلک آن در تولید سلاحهای هستهای میباشد. احتمالاً اخلاط این دو دیدگاه است که باعث گزافه گوییهای احساسی در خصوص سمی بودن پلوتونیم میشود. در سال ۱۹۸۹ نوشتهای از برنارد ال کوهن، اینگونه بیان میکند که «خطرات پلوتونیوم خیلی آشکارتر و راحت تر از خطرات ناشی از مواد افزودنی به غذاها و همچنین حشره کش ها فهمیده میشوند و در مقایسه تنها یک مرگ در هر ۳۰۰ سال میتواند کم مایه بودن این نظر را اثبات کند؛ و علیرغم حقایقی که ما در اینجا ذکر کردیم و حقایق شناخته شده بر جامعه علمی افسانه سمی بودن پلوتونیوم همچنان ادامه دارد.»[۲] بنابراین هیچ گونه شک و تریدی وجود ندارد که پلوتونیوم در صورت استفاده نادرست میتواند بسیار خطرناک باشد. پرتوی آلفا که پلوتونیوم از خود ساطع میکند نمیتواند به پوست نفوذ کند اما میتواند به اندامهای داخلی در صورت تنفس یا خوردن پلوتونیوم آسیب برساند. ذرات بسیار کوچک پلوتونیم در صورت تنفس و رسیدن به ریهها میتوانت باعث به وجود آمدن سرطان ریه شود. مواد دیگر از جمله رایسین، سم بوتولینوم و سم کزاز در دوزهایی کمتر از یک میلیگرم، میتوانند کشنده باشند، بنابراین پلوتونیوم از این نظر غیرعادی نیست. مقادیر قابل توجه بیشتر آن، در صورت بلع یا تنفس، میتواند باعث به وجود آمدن مسمومیت رادیویی حاد و مرگ شخص شود. در ژانویهٔ سال ۲۰۱۶ میلادی یک تیم تحقیق بریتانیایی فاش ساخت که آلکساندر لیتویننکو (مأمور سابق کاگب و مخالف سیاستهای ولادیمیر پوتین) در سال ۲۰۰۶ به دستور ولادیمیر پوتین در لندن به قتل رسید و هیئت تحقیق وجود مقادیری پلوتونیم در قوری چای او را تأیید کردند. بسیاری از مردم مقدار قابل توجهی پلوتونیوم در بدن خود دارند.
ویژگی های پلوتونیوم: این فلز ظاهری نقرهای رنگ دارد و هنگامی که اکسید میشود رنگش تا حدی به زرد تیره میگراید. اگر مقدار زیادی از پلوتونیوم در جایی جمع شود به قدری گرم میشوند که نمیتوان آن را لمس کرد و دلیل آن نیز ساطع کردن انرژی آلفا میباشد. مقادیر بیشتر گرمای لازم را برای جوشاندن آب به وجود میآورد. این فلز به سرعت در اسید هیدرویدیک یا اسید پرکلریک غلیظ، حل میشود. این فلز شش حالت آلوتروپیک با ساختارهای بلورین گوناگون از خود نشان میدهد که چگالی آنها از ۱۶٫۰۰ تا ۱۹٫۸۶ متغیر است.
عنصر مورد علاقت تو جدول مندلیف چیه؟ بنظرت پلوتونیوم مفیده یا مضر؟
اگر پسندیدی، لایک کن و به سازنده انرژی بده!


خیلی خوب بود.
اگه دوست داشتی میتونی به تست { اجزای اتم} و { پنج
آزمایش جالب شیمی } سر بزنی
خیلی ممنون و حتما
❤️
عالی عالی عالی عالیییی×1000000000000000000
سپاس🙏
زیباست گذری که از کوچه شما باشد! 🌹🚶♀️
خسته نباشید 🌹🚶♀️
ممنون🌹
عالی🌷
ویژه
ممنون🌹
عااالی
ممنون🌹