15 اسلاید پست توسط: دکتر محمدباقر انتشار: 9 ساعت پیش 17 مرتبه مشاهده شده گزارش ذخیره در مورد علاقه ها افزودن به لیست
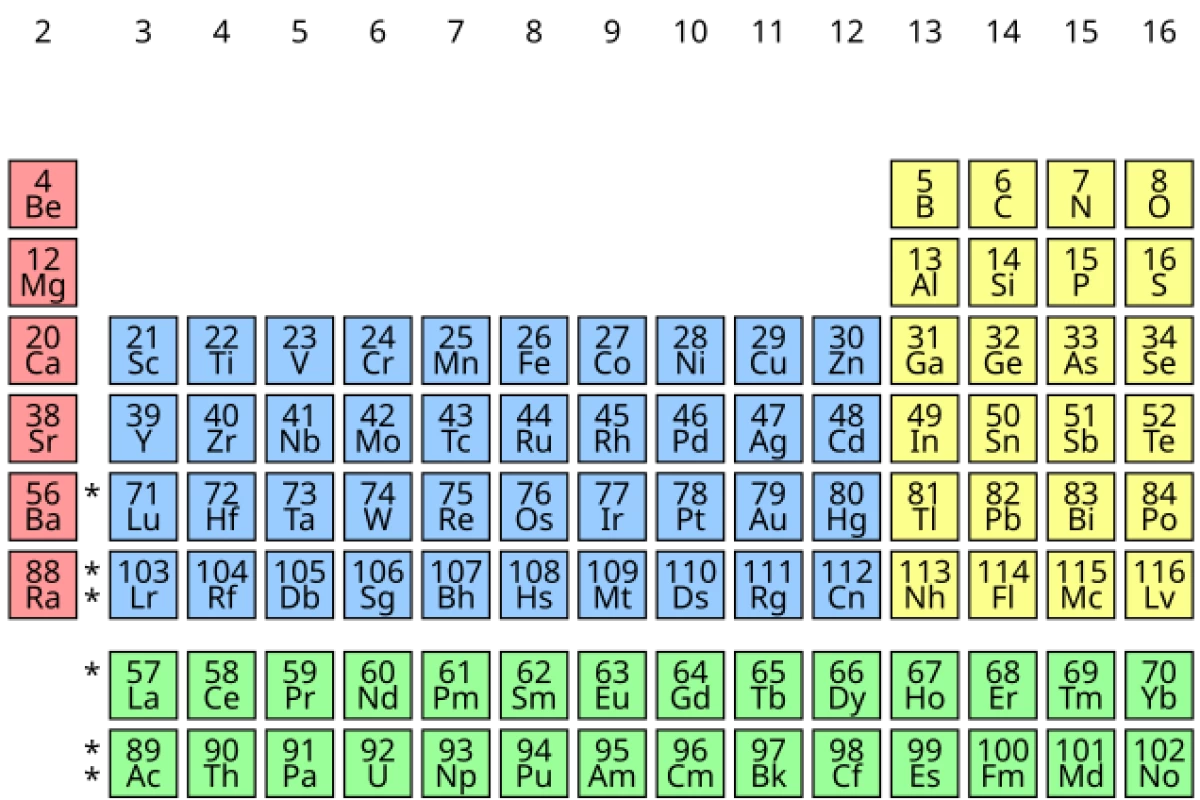
جدول تناوبی عنصرهای شیمیایی یا جدول دورهای عنصرهای شیمیایی یا جدول مَندَلیُف (به انگلیسی: Periodic table یا periodic table of elements)، نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد اتمی (شمار پروتونها) کمتر به سوی عدد اتمی بالاتر است. شکل استاندارد این جدول ۱۸ × ۷ است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار بلوک مستطیلی عبارتند از: بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی (فلزات واسطه) در وسط و بلوک اف (فلزات واسطهٔ داخلی) در پایین. ردیفهای این جدول، دوره و ستونهای آن، گروههای جدول تناوبی نام دارند. همچنین گاهی برخی از این گروهها نامهای ویژهای دارند. برای نمونه گروه هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی، چه به شکل مستطیلی و چه به شکلهای دیگر، بررسی بهتر ویژگیهای شیمیایی عنصرها بوده است. این جدول، کاربرد زیادی در دانش شیمی و پردازش رفتار عنصرها دارد.
جدول تناوبی با نام دیمیتری مندلیف شناخته شده است، با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او جدولی مشابه جدول تناوبی امروزی را در سال ۱۸۶۹ منتشر کرد. این، نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را تهیه کرد تا ویژگیهای دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و جای آنها را خالی گذاشته بود.[۱] کمکم با پیشرفت دانش، عنصرهای تازهای شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیهسازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گستردهتر شده است.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (اوگانسون) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از اوگانسون هستند و البته این پرسش را پیش رو دارند که عنصرهای تازهتر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شده است.
ظاهر
ویرایش
همهٔ نسخههای جدول تناوبی تنها دربردارندهٔ عنصرهای شیمیایی هستند و مخلوط، ترکیب یا ذرهٔ زیراتمی در آنها جایی ندارد.[پ ۱] هر عنصر شیمیایی یک عدد اتمی یکتا دارد و این عدد برابر با شمار پروتونها در هستهٔ اتم آن عنصر است. اتمهای گوناگون یک عنصر میتوانند شمار نوترونهای متفاوتی داشته باشند. در این حالت به آنها ایزوتوپ گفته میشود. برای نمونه کربن سه ایزوتوپ طبیعی دارد. همهٔ ایزوتوپهای کربن ۶ پروتون، و بیشتر آنها ۶ نوترون دارند؛ اما یک درصد آنها ۷ نوترون و شمار بسیار کمتری از آنها ۸ نوترون دارند. ایزوتوپها در جدول تناوبی به صورت جداگانه، نمایش داده نمیشوند؛ بلکه میانگین آنها به عنوان جرم اتمی در زیر عنصر درج میشود. برای عنصرهایی که هیچ ایزوتوپ پایداری ندارند، جرم اتمی پایدارترین یا متداولترین ایزوتوپ آنها درون پرانتز نوشته میشود.[۲]
در جدول تناوبی استاندارد عنصرها به ترتیب عدد اتمی (شمار پروتونها در هسته)، به صورت صعودی مرتب شدهاند. هر ردیف تازه در جدول، که یک دوره یا تناوب نامیده میشود، با افزوده شدن نخستین الکترون به یک لایهٔ الکترونی تازه آغاز میشود. عنصرهایی که در یک ستون جدول (گروه) جای گرفتهاند، همگی در لایهٔ آخر الکترونی خود دارای تعداد الکترونهای برابر هستند؛ به عبارت دیگر آرایش الکترونی لایهٔ آخر آنها یکسان است. مانند اکسیژن و سلنیم که هر دو در یک ستون هستند و هر دو چهار الکترون در لایهٔ بیرونی آرایش الکترونی خود یعنی تراز p دارند. عنصرهایی که ویژگیهای شیمیایی مشابه دارند، معمولاً در یک گروه از جدول قرار میگیرند. اما در بلوک f عنصرهایی که در یک دوره هستند نیز ویژگیهای مشابهی را نشان میدهند. در نتیجه به آسانی میتوان ویژگیهای شیمیایی یک عنصر را با آگاهی از عنصرهای پیرامونیاش پیشبینی کرد.[۳]
تا سال ۲۰۱۵، جدول تناوبی ۱۱۸ عنصر داشته است که ۱۱۴ عنصر به صورت رسمی از سوی اتحادیه بینالمللی شیمی محض و کاربردی پذیرفته و نامگذاری شدهاند. ۹۸ عنصر از مجموع ۱۱۸ عنصر در طبیعت یافت میشوند و از آن میان، ۸۴ مورد، عنصرهای پایدار یا دارای نیمعمر بیش از سن زمین هستند. در حالی که ۱۴ عنصر باقیمانده نیمعمر کوتاهی دارند یا به عبارت دیگر پرتوزا هستند. در حال حاضر، این عنصرها تنها بر اثر انجام واکنش هستهای در عنصرهای دیگر به وجود میآیند و فراوانی ناچیزی دارند.[۴] تمام عنصرهای با عدد اتمی ۹۹ تا ۱۱۲ (که مابین اینشتینیم و کوپرنیسیم قرار دارند) و نیز دو عنصر فلروویوم و لیورموریوم، در طبیعت پدید نیامدهاند، بلکه در آزمایشگاه ساخته شدهاند. سپس آیوپاک آنها را بهطور رسمی پذیرفته است. گزارش شده که عنصرهای ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ هم در آزمایشگاه ساخته شدهاند، اما هنوز آیوپاک آنها را تأیید نکرده است. برای همین، این عنصرها هنوز بر پایهٔ عدد اتمیشان شناخته میشوند.[۵] تاکنون عنصری سنگینتر از کالیفرنیم (عنصر ۹۸) در طبیعت به صورت خالص در اندازهٔ قابل مشاهده، پیدا نشده است.[۶] تا سال ۲۰۱۸ هنوز عنصری با عدد اتمی بزرگتر از ۱۱۸ ساخته نشده است.[۷]
روش دستهبندی
ویرایش
عنصرها در جدول تناوبی به صورت افقی (چپ به راست) در گروههای ۱ تا ۱۸ و به صورت عمودی (بالا به پایین) در دورههای ۱ تا ۷ دستهبندی میشوند. همچنین دستهبندی دیگری بر اساس لایهٔ الکترونی در حال پر شدن وجود دارد که بر اساس آن، عنصرها در بلوکهای s و p و d و f قرار میگیرند.
گروههای جدول تناوبی
یک گروه یا خانواده، یک ستون عمودی از جدول تناوبی است. عنصرهای یک گروه معمولاً ویژگیهای نزدیک به هم بیشتری نسبت به عنصرهای یک دوره یا بلوک دارند. دانش مکانیک کوانتوم که دربارهٔ ساختار اتمی پژوهش میکند، نشان میدهد که چون عنصرهای موجود در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی برخوردارند؛[۸] بنابراین ویژگیهای شیمیایی مشابهی از خود نشان میدهند و هرچه عدد اتمی آنها بالاتر میرود، این مشابهتها افزایش پیدا میکند.[۹] با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ همانندیها در یک گروه مهم هستند. به همانندی (شباهت) در یک دوره، همانندی افقی و در یک گروه، همانندی عمودی گفته میشود.[۱۰][۱۱][۱۲]
بر اساس یک قرارداد جهانی، گروهها از ۱ تا ۱۸ شمارهگذاری شدهاند که گروه شمارهٔ یک را نخستین گروه از چپ (فلزهای قلیایی) و آخرین گروه را گروه نخست از راست (گازهای نجیب) در نظر گرفتهاند.[۱۳] در گذشته، شمارهٔ گروهها را با عددهای رومی نشان میدادند. همچنین در آمریکا برای گروههای بلوک اس و پی یک حرف A و برای عنصرهای بلوک دی یک حرف B در کنار شمارهٔ رومی گروه میگذاشتند. برای نمونه گروه چهار به صورت IVB و گروه چهاردهم (یا عنصرهای گروه کربن) به صورت IVA نمایش داده میشد. در اروپا هم همین روش به کار میرفت، با این تفاوت که حرف A برای گروههای پیش از گروه ۱۰ و حرف B برای عنصرهای گروه ۱۰ و گروههای پس از آن بکار میرفت. در سال ۱۹۸۸ آیوپاک سامانهٔ نامگذاری تازهای را پیشنهاد کرد و روشهای پیشین همگی فراموش شد.[۱۴]
نامگذاری نخستین گروهها
۱ فلزهای قلیایی
۲ فلزهای قلیایی خاکی
۱۱ فلزهای سکه
۱۲ فلزهای فرار (کم کاربرد
۱۳ گروه بور
۱۴ گروه کربن
۱۵ گروه نیتروژن
۱۶ کالکوژنها
۱۷ هالوژنها
۱۸ گاز نجیب
ویژگیهای عنصرهای یک گروه مانند شعاع اتمی، انرژی یونش و الکتروندوستی مشابه یکدیگر هستند. از بالا به پایین، شعاع اتمی عنصرها افزایش مییابد، در نتیجه الکترونهای لایهٔ آخر در فاصلهٔ دورتری از هسته جای میگیرند، چون ترازهای انرژی بیشتری پُر شدهاند. از بالا به پایین، انرژی یونش کاهش مییابد. چون الکترونها کمتر به هسته پیوند خوردهاند و آسانتر میتوان آنها را جدا کرد. با تحلیل مشابه، از بالا به پایین الکتروندوستی عنصرها کاهش مییابد. چون فاصلهٔ میان الکترونهای لایهٔ آخر و هسته افزایش مییابد.[۱۵] البته در این میان استثناهایی هم وجود دارد. برای نمونه در گروه ۱۱ الکتروندوستی از بالا به پایین افزایش مییابد.[۱۶]
دوره (جدول تناوبی)
یک دوره در جدول تناوبی، یک ردیف افقی از این جدول است. با اینکه عنصرها در یک گروه همانندیهای بسیاری دارند، اما بخشهایی از دورهها هستند که از اهمیتی بیش از گروهها برخوردارند. مانند بلوک F، جایی که لانتانیدها و آکتینیدها دو مجموعهٔ افقی از عنصرهای جدول را میسازند.[۱۷]
عنصرها در یک دوره همانندیهایی از لحاظ شعاع اتمی، انرژی یونش، الکتروندوستی و الکترونخواهی (مقدار انرژی آزاد شده هنگامی که یک الکترون به یک مولکول یا اتم خنثی افزوده میشود) از خود نشان میدهند. در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد. این پدیده، به این دلیل است که با افزایش عدد اتمی در یک دوره، شمار لایههای الکترونی ثابت است، اما شمار پروتونها افزایش مییابد. برای همین الکترونها بیشتر به سوی هسته کشیده میشوند.[۱۸] کاهش شعاع اتمی باعث افزایش انرژی یونش میشود (از چپ به راست). هرچه پیوندها در یک عنصر محکمتر باشد، انرژی بیشتری هم برای جداسازی یک الکترون نیاز است. الکتروندوستی مانند انرژی یونش رفتار میکند و از چپ به راست افزایش مییابد. چون کشش هسته بر روی الکترونها افزایش مییابد.[۱۵] همچنین مقدار الکترونخواهی هم در طول یک دوره اندکی تغییر میکند. فلزها (عنصرهای سمت چپ دوره) معمولاً نسبت به نافلزها (سمت راست دوره) الکترونخواهی پایینتری دارند. این قانون برای گازهای نجیب برقرار نیست.[۱۹]
بلوک
ویرایش
چون لایهٔ آخر الکترونی از اهمیت ویژهای برخوردار است، جدول تناوبی به بخشهایی وابسته به این لایههای الکترونی تقسیم شده است. به هر یک از این بخشها یک بلوک میگویند.[۲۰] بلوک اس دربردارندهٔ دو گروه نخست جدول (فلزهای قلیایی و قلیایی خاکی) و دو عنصر هیدروژن و هلیم است. بلوک پی دربردارندهٔ شش گروه آخر جدول، گروههای ۱۳ تا ۱۸ آیوپاک (۳A تا ۸A در نامگذاری آمریکایی) است. همهٔ شبهفلزات و نافلزها در این بلوک جای میگیرند. بلوک دی دربردارندهٔ گروههای ۳ تا ۱۲ آیوپاک (۳B تا ۸B در نامگذاری آمریکایی) و همهٔ فلزات واسطه است. بلوک اف که بیشتر در پایین بدنهٔ اصلی جدول جای میگیرد دربردارندهٔ لانتانیدها و اکتینیدها است.[۲۱]
دیگر قراردادها
ویرایش
در نمایش جدول تناوبی، لانتانیدها و اکتینیدها بیشتر به صورت دو ردیف اضافی در زیر بدنهٔ اصلی جدول گذاشته میشوند.[۲۲] همچنین در این نمایش، دو تکخانه از بدنهٔ اصلی جدول به یکی از عنصرهای این دو مجموعه اختصاص داده میشود. برای نمونه، یکی از عنصرهای لانتانیوم یا لوتسیم (برای لانتانیدها) و اکتینیم یا لارنسیم (برای اکتینیدها) را برمیگزینند و آنها را به ترتیب در یک تکخانه میان باریم و هافنیم، و رادیم و رادرفوردیم میگذارند. در دیگر جدولها، دو مجموعهٔ لانتانیدها و اکتینیدها به صورت دو ردیف (دوره) در میانهٔ بدنهٔ اصلی جدول جای داده میشود.
در برخی جدولها یک خط جداکنندهٔ فلزها از نافلزها هم گنجانده میشود.[۲۳] همچنین ممکن است در یک جدول دستههای گوناگونی از عنصرها به صورت برجستهتری نمایان شوند. برای نمونه میتوان به فلزهای واسطه، فلزات پس واسطه و شبهفلزها اشاره کرد.[۲۴] همچنین بسته به کاربرد جدول، ممکن است گروههای ویژهای از عنصرها مانند فلزهای دیرگداز و فلزهای کمیاب که خود زیرگروه فلزهای واسطه هستند، به صورت پررنگتر نمایش داده شوند.[۲۵][۲۶]
ویژگیهای تناوبی
رایش الکترونی عنصرهای جدول، الگویی تکرار شونده دارند. الکترونها در هر عنصر، مجموعهای از لایههای الکترونی را پُر میکند. هر لایهٔ الکترونی از یک یا چند زیرلایه ساخته شده است که به آنها لایههای s و p و d و f و g گفته میشود. هر چه عدد اتمی یک عنصر افزایش یابد، لایهها و زیرلایههای الکترونی بیشتری در آن عنصر پُر میشود. این لایهها بر پایهٔ اصل آفبا یا قانون تراز انرژی پر میشوند (همانند نموداری که کشیده شده است). برای نمونه، آرایش الکترونی نئون با عدد اتمی ۱۰ عبارت است از: 1s2 2s2 2p6 که دو الکترون در لایهٔ نخست و هشت الکترون در لایهٔ دوم (دو تا در زیرلایهٔ s و شش تا در زیرلایهٔ p) جای میگیرد. برای نمونه، فلزهای قلیایی و عنصر هیدروژن، همگی تنها یک الکترون در لایهٔ اس دارند.[۲۷][۲۸]
ویژگیهای یک عنصر بیشتر به آرایش الکترونی آن عنصر وابسته است. در نتیجه، چون آرایش الکترونی عنصرها در جدول از نظم روشنی پیروی میکند، میتوان برخی رفتارهای فیزیکی و شیمیایی عنصرها در جدول را پیشبینی کرد. در نمودار سمت راست، به برخی از این رفتارها اشاره شده است. پیش از آنکه نیلز بور نظریه خود پیرامون آرایش الکترونی را مطرح کند، از روی این ویژگی پلهکانی عنصرها، جای برخی از عنصرها در جدول پیشبینی شده بود.[۲۷][۲۸]
شعاع اتمی
اندازهگیری شعاع اتمی یک اتم به صورت مجزا امکانپذیر نیست؛ ولی میتوان با اندازهگیری فاصلهٔ میان هستههای دو اتم که با هم پیوند دارند، شعاع اتمی آنها را به دست آورد. برای نمونه، هنگامی که دو اتم یک عنصر با یکدیگر پیوند دارند، شعاع اتمی هر یک از آنها نصف طول پیوند دو اتم است. هرچند که این مقدار در پیوندهای مختلف، اندکی متفاوت است؛ ولی میتوان یک میانگین را برای شعاع اتمی در نظر گرفت. بهطور کلی، با حرکت به سمت چپ و پایین جدول تناوبی، شعاع اتمی افزایش مییابد.[۲۹] این تغییر شعاع اتمی و در کنار آن تغییر در ویژگیهای فیزیکی و شیمیایی عنصرها را میتوان با کمک نظریههای اتمی دربارهٔ لایههای الکترونی توضیح داد. این تغییرها شاهدی بر درستی نظریهٔ کوانتوم است.[۳۰]
عنصرهای واسطه از الگوی کلی تغییرات شعاع اتمی پیروی نمیکنند. در آغاز پر شدن لایهٔ d شعاع اتمی کاهش مییابد که نرخ آن از نرخ کاهش عنصرهای گروه ۲ نسبت به گروه ۱ بسیار کمتر است؛ ولی در اتمهای انتهایی، روند افزایشی وجود دارد.[۳۱]
انرژی یونش
نخستین انرژی یونش، انرژی لازم برای جدا کردن سستترین الکترون از یک اتم خنثی در حالت گازی است. دومین انرژی یونش، انرژی مورد نیاز برای جدا کردن دومین الکترون از یک اتم است. انرژیهای یونش مراتب بالاتر نیز به همین ترتیب تعریف میشوند. برای یک اتم مشخص، با افزایش درجهٔ یونش، انرژیهای یونش متعاقب هم افزایش مییابند. بر الکترونهای لایههای نزدیکتر به هسته، نیروی جاذبهٔ الکترواستاتیک بیشتری اعمال میشود؛ بنابراین انرژی مورد نیاز برای جداسازی آنها نیز بیشتر است. انرژی یونش با حرکت به سمت بالا و راست جدول تناوبی، افزایش مییابد.[۳۱]
در هر دورهٔ جدول، دو پرش بزرگ دیده میشود. یک پرش در گذر از گاز نجیب به فلز قلیایی بعدی است. پرش دوم که کوچکتر است، پیش از گروه ۱۳ رخ میدهد. در هر دو حالت، ابتدا آخرین لایهٔ آرایش الکترونی پر شده و سپس الکترون بعدی در لایهٔ جدید قرار میگیرد؛ بنابراین انرژی مورد نیاز برای جدا کردن آن، بسیار کمتر خواهد بود. چنین رخدادی در انرژیهای یونش متوالی یک عنصر نیز مشاهده میشود. هنگامی که همهٔ الکترونهای یک لایه جدا شوند، انرژی یونش بعدی به شدت افزایش مییابد.[۳۲]
الکترونگاتیوی
الکترونگاتیوی، تمایل یک اتم به جذب الکترون است که به دو عامل عدد اتمی و فاصلهٔ الکترونهای لایهٔ آخر آن اتم با هسته وابسته است. این ویژگی در سال ۱۹۳۲ توسط لینوس پاولینگ پیشنهاد شد. الکترونگاتیوی با حرکت به سمت بالا و راست جدول تناوبی، افزایش مییابد. فلوئور بیشترین و سزیم کمترین میزان الکترونگاتیوی را در میان عنصرهایی که در طبیعت یافت میشوند، دارا هستند.[۳۳]
استثناهایی در تغییرات تناوبی الکترونگاتیوی مشاهده میشوند. الکترونگاتیوی عنصرهای گروه ۱۳ و ۱۴ در دورهٔ چهارم بیشتر از دورهٔ سوم است که دلیل آن، پر شدن لایهٔ d (که درونیتر است) و کمتر شدن شعاع اتمی است. استثنای دیگر، بالا بودن غیرعادی الکترونگاتیوی سرب در مقایسه با عنصرهای پیرامونش است که به نظر میرسد به دلیل اشکال در تحلیل دادهها باشد.[۳۴] روشهای محاسباتی دیگر، متفاوت با آنچه مورد استفاده پاولینگ بوده، نشان میدهند که این عنصرها دارای رفتار دورهای طبیعی هستند.[۳۵]
تفاوت الکترونگاتیوی میان دو اتم که پیوندی را تشکیل میدهند، میزان خصلت یونی آن پیوند را نشان میدهد. هرچه این تفاوت بیشتر باشد، پیوند دو اتم قطبیتر است. برای نمونه، در پیوند میان نافلزها که تفاوت الکترونگاتیوی اندک است، پیوند کووالانسی با قطبیت کم یا غیر قطبی است؛ ولی پیوند میان یک فلز و یک نافلز به دلیل تفاوت قابل توجه الکترونگاتیوی دو اتم، از نوع پیوند یونی است. معیار الکترونگاتیوی چندان دقیق نیست؛ زیرا دو اتم ممکن است به شکلهای گوناگونی با یکدیگر پیوند داشتهباشند. (برای نمونه الکترونگاتیوی فسفر در دو ترکیب PF3 و PF5 با یکدیگر متفاوت است)[۳۴]
الکترونخواهی
الکترونخواهی، انرژی واکنش افزوده شدن یک الکترون به یک اتم در حالت گازی و تبدیل اتم خنثی به یون منفی است. برای بیشتر عنصرها، این فرایند با آزاد شدن انرژی همراه است و در نتیجه، مقدار الکترونخواهی برای نخستین الکترون، مقداری منفی است. تنها الکترونخواهی فلزات قلیایی خاکی (گروه ۲)، گروههای ۷ و ۱۲ و گازهای نجیب (گروه ۱۸) مثبت است. (در واقع، برای این عنصرها مقدار تجربی الکترونخواهی اندازهگیری نشده است) دلیل این رخداد، پر بودن (مانند گروه ۲، ۱۲ و ۱۸) یا نیمهپر بودن آخرین لایهٔ آرایش الکترونی این عنصرها (مانند گروه ۷) است. الکترونخواهی عنصرهای گروه ۱۵ نیز به دلیل نیمهپر بودن لایهٔ p کمتر از گروههای مجاور است. در هر دوره، بیشترین الکترونخواهی منفی مربوط به گروه هالوژنها است. کلر بیشترین مقدار الکترونخواهی را در میان عنصرهای جدول تناوبی دارد.[۳۶]
سال جهانی جدول تناوبی
ویرایش
سال ۲۰۱۹ (۹۸–۱۳۹۷ خورشیدی) به دلیل ۱۵۰ ساله شدن ایجاد جدول تناوبی، توسط سازمان ملل، سال جهانی جدول تناوبی عناصر شیمیایی (IYPT 2019) نامگذاری شد.[۱۰۵]
15 اسلاید
1
نتیجه
مجموع امتیاز شما
امتیاز
تعداد پاسخ صحیح
تعداد پاسخ غلط
درصد صحیح
شما به درصد سوالات پاسخ درست دادید
اگر پسندیدی، لایک کن و به سازنده انرژی بده!
11 لایک


عالی بود ولی حوصله نداشتم بخونم🙏
وییژهه